合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 4种不同组分的混合溴化盐表面张力σ-t经验公式系数与相关性研究(三)
> 4种不同组分的混合溴化盐表面张力σ-t经验公式系数与相关性研究(二)
> 4种不同组分的混合溴化盐表面张力σ-t经验公式系数与相关性研究(一)
> PH、结构、电荷与温度对胶原生物表面活性剂溶液性质的影响机制(二)
> PH、结构、电荷与温度对胶原生物表面活性剂溶液性质的影响机制(一)
> 入网变压器油界面张力不合格率检测、原因分析及处理
> Ce含量对Mg-1.2Ca镁合金阻燃性能及表面张力的影响研究(二)
> Ce含量对Mg-1.2Ca镁合金阻燃性能及表面张力的影响研究(一)
> 非极性、极性烃油及混合物在磁场改性下的表面张力变化特性
> 界面张力主导:残余气饱和度的深部咸水层CO2封存潜力评估(三)
(Delta-8)橄榄油两性表面活性剂之间的协同作用和阴离子表面活性剂——结果和讨论、结论、致谢!
来源:上海谓载 浏览 2646 次 发布时间:2021-12-29
结果和讨论
制备与结构表征
橄榄油含有各种脂肪酸甘油酯。我们使用GC-MS色谱法测定其结构和含量,如表1所示。显然,橄榄油最主要的成分是油酸甘油酯(74.48%),其次是棕榈酸甘油酯(14.11%)和硬脂酸甘油酯(6.62%)。
表1。橄榄油的成分(wt%)。

通过FI-IR光谱(图1)和正离子模式下的ESI-MS光谱(图2和图3)对源自橄榄油的羧基甜菜碱和磺基甜菜碱进行了表征。这些光谱特征的细节如下。在所有情况下,获得的光谱与这些化合物的指定结构一致。羧基甜菜碱和磺基甜菜碱的产率分别为90.24%和73.28%。

图1。OCB和OSB的FT-IR光谱。
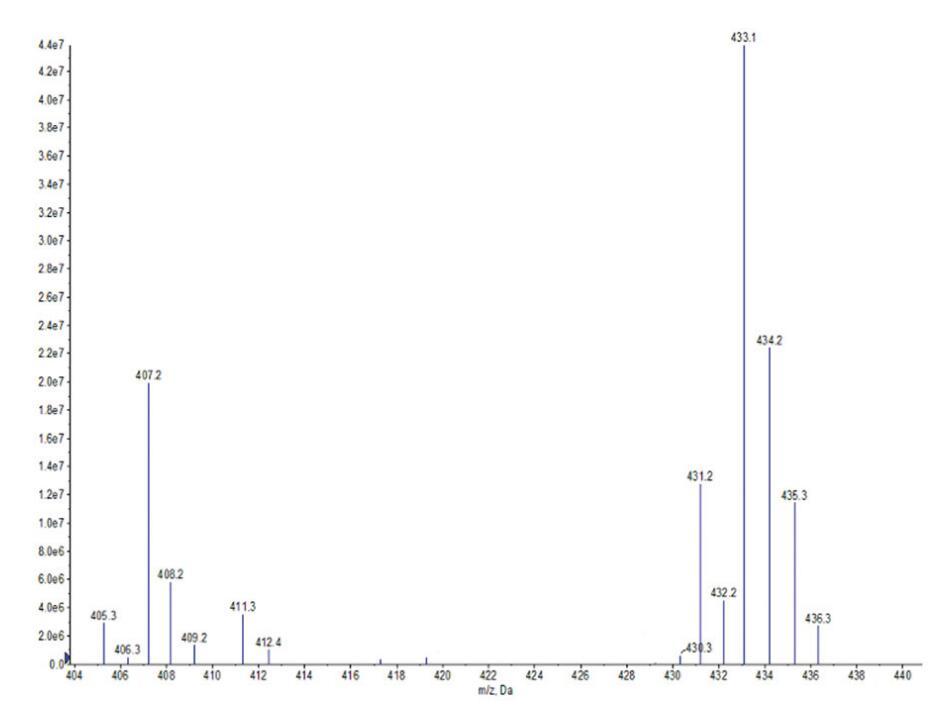
图2。OCB的ESI-MS光谱。

图3。OSB的ESI-MS光谱。
OCB:IR:3363 cm-1(N-H)、1596 cm-1(C=O)、1250 cm-1(C-O)、1421 cm-1(酰胺键中的C-N)和1069 cm-1(季铵基中的C-N)。ESIMS:m/z=411.3,409.2分别归因于由油酸甘油酯(C18:1)和亚油酸甘油酯(C18:2)与H+衍生的羧基甜菜碱;m/z=407.2、405.3、435.3、433.1、431.2,分别与来自棕榈酸甘油酯(C16)、棕榈油酸甘油酯(C16:1)、硬脂酸甘油酯(C18)、油酸甘油酯(C18:1)和亚油酸甘油酯(C18:2)的含Na+的羧基甜菜碱相匹配。
OSB:IR:3370 cm-1(N-H)、1657 cm-1(C=O)、1552 cm-1(N-H)、1459 cm-1(酰胺键中的C-N)、1047 cm-1(季铵基中的C-N)、1201 cm-1和530 cm-1(-SO3-)。ESI-MS:m/z=491.3,489.2分别归因于由油酸甘油酯(C18:1)和亚油酸甘油酯(C18:2)与H+衍生的羧基甜菜碱;m/z=487.2、485.3、515.1、513.1、511.2分别与从棕榈酸甘油酯(C16)、棕榈烯酸(C16:1)、硬脂酸甘油酯(C18)、油酸甘油酯(C18:1)和亚油酸甘油酯(C18:2)中提取的含Na+的羧基甜菜碱相匹配。
等电点
表面活性剂溶液的pH值和电导率之间的关系如图4所示。从橄榄油中提取的羧基甜菜碱和磺基甜菜碱表面活性剂显示出广泛的pI,是典型的两性离子物种。如图所示,制备产物的pI值为pH 4.0–10.0,其中分子存在于内部盐化合物中。也就是说,这些新型表面活性剂在溶液中的pH值为4.0–10.0时为两性(中性)。当pH值低于4.0或高于10.0时,它们表现出阳离子或阴离子行为,并显示出高导电性。
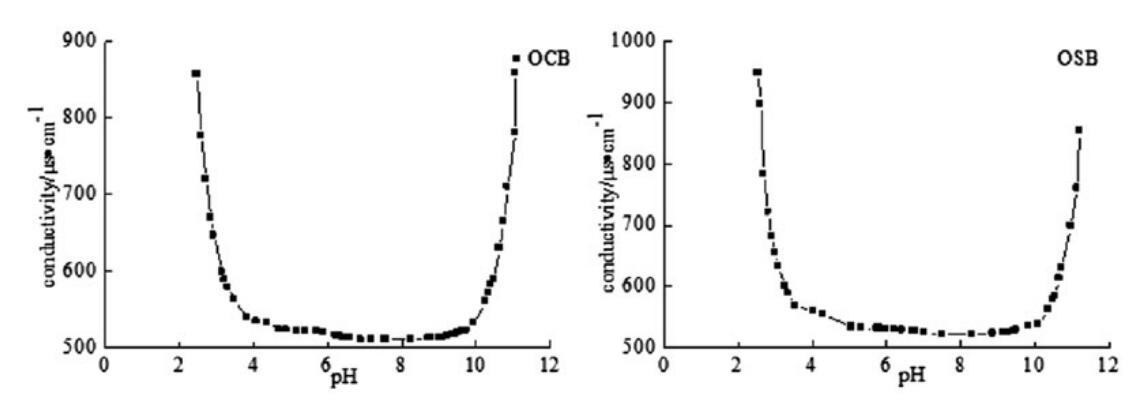
图4。OCB和OSB在25℃时的pH电导率曲线。
本文研究了OCB和OSB的pI值,因为荷电表面活性剂之间的相互作用在协同作用(胶束相)和沉淀(如果系统处于正负电荷分子的高过饱和状态,则在单体相)方面至关重要。为了讨论合成的两性表面活性剂在真正两性状态下的协同效应,我们决定在pH=7时进行以下实验。
OCB/SDBS系统
在25℃下测量了不同摩尔比的OCB、SDBS和OCB/SDBS混合体系的表面张力。OCB/SDB(αOCB)的比率从0.2,0.4,0.6更改为0.8,总摩尔浓度固定为0.1 mol/L。图5说明了浓度与表面张力之间的关系,表2总结了表面张力参数。
表2。OCB/SDS体系在25℃水溶液中不同摩尔分数(αOCB)的表面性质。
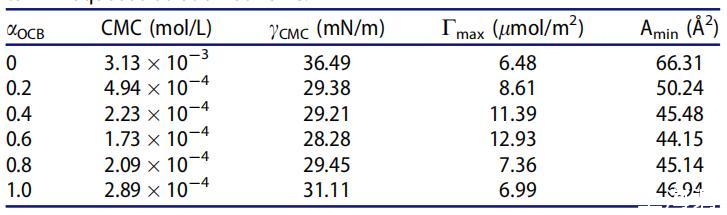
很明显,二元表面活性剂混合物在混合范围内的CMC和γCMC值低于单一表面活性剂,表明其在水溶液中具有更好的表面活性。随着OCB摩尔分数的增加,CMC和γCMC值降低,在αOCB=0.6时,最低值为1.73*10-4 mol/L和28.28 mN/m。认为OCB的季铵阳离子部分与SDB的SO3-基团之间的强静电吸引以及不同烃链之间的疏水作用导致混合胶束的形成并提高表面活性。[20]当αOCB大于0.6时,单个表面活性剂的自相互作用逐渐优先于胶束的形成。因此,OCB和SDB之间的静电相互作用被降到次要位置,CMC和γCMC值正在增加。[21,22]

图5。不同摩尔比下单独OCB、SDS和混合OCB/SDS的表面张力与浓度对数的关系。
根据吉布斯吸附等温线方程(方程1和2)[23]的近似形式计算最大表面过剩(Cmax)和最小表面积(Amin):
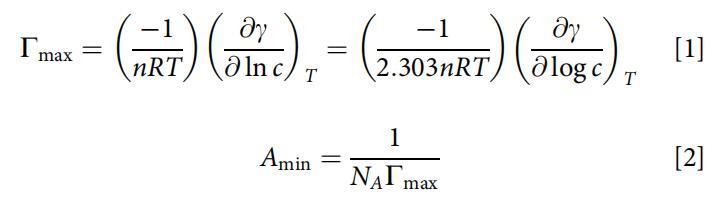
式中,c为表面活性剂水溶液的浓度,R=8.314 J/(mol·K),T为绝对温度,n为两性离子表面活性剂的1,( c/ ln c)为浓度接近CMC时表面张力等温线的斜率,NA为阿伏伽德罗数。
Cmax和Amin表征了表面活性剂分子在气液界面的堆积密度。Cmax值越大或Amin值越小意味着表面活性剂分子在空气/水界面的堆积越紧密。[24]与单一化合物相比,在整个组成范围内,OCB/SDBS混合物在空气/水界面上的密度更大,表明聚集密度更高,更能降低水的表面张力。αOCB=0.6时,表面活性剂混合物的最大Cmax值和最小Amin值表明,在所有研究的摩尔分数内,OCB和SDB的吸引力最强。
从Clint方程(方程3)[25]中获得了描述混合胶束形成理想状态的理论理想混合CMCid:
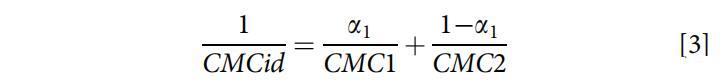
其中a1是总混合物中表面活性剂1(即OCB)的摩尔分数,CMC1和CMC2分别是纯表面活性剂1(即OCB)和表面活性剂2(即SDB)的CMC。
理想CMC值如表3所示,并与图6中的实验CMC值一起绘制为OCB摩尔分数的函数。CMC与CMCid的偏差可以预测混合胶束的非理想性。结果表明,对于所研究的系统,实验CMC值低于CMCid。由于结构的不同,这种偏差与二元体系的非理想混合行为一致,CMC的值低于相应的CMCid值可归因于不同表面活性剂之间的吸引作用导致的混合胶束形成。
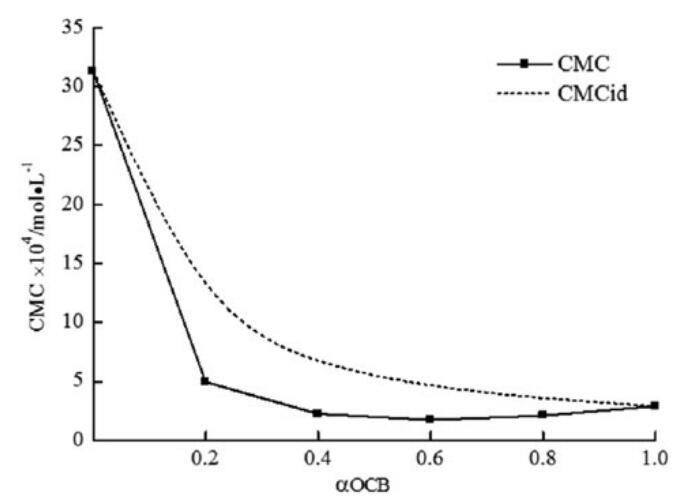
图6。研究了实验CMC、理想CMC与OCB摩尔分数的关系。
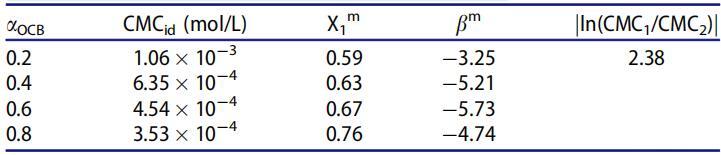
表3。25℃水溶液中OCB/SDS体系不同摩尔分数(αOCB)的非理想性及相互作用参数。
对于非理想的表面活性剂混合物,两性表面活性剂OCB和阴离子表面活性剂SDB在水溶液中的分子相互作用强度通常由胶束相互作用参数bm来评估。根据正则解理论,bm可通过以下方程式(方程式4和5)[26]计算:
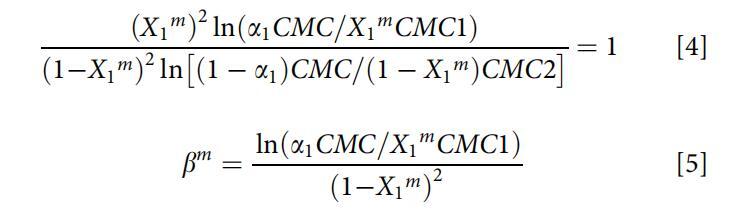
其中X1m是混合胶束中表面活性剂1(即OCB)的摩尔分数,CMC1、CMC2和CMC分别是表面活性剂1(即OCB)、表面活性剂2(即SDB)和混合物在摩尔分数a1(即OCB)处的临界胶束浓度。
如表3所示,混合物在各摩尔分数下的bm值为负值,这意味着两性状态下的OCB与混合胶束中的SDB之间存在有吸引力的相互作用。bm的负值越大,胶束化过程中表面活性剂分子之间的相互作用越强烈。[27]bm值与αOCB成反比下降,并在αOCB=0.6时达到最小值,表明OCB/SDBS系统在整个组成范围内的吸引力最强。此外,bm参数可被视为在给定二元系统中存在协同作用的指示。当混合胶束体系的CMC低于纯表面活性剂的CMC时,混合胶束体系表现出协同作用,必须满足两个条件:(1)bm必须为负;(2)jbmj>jln(CMC1/CMC2)j。从表3中提供的数据可以得出结论,本研究中pH=7时表面活性剂混合物的所有摩尔比均满足所用标准。因此,在所研究的OCB/SDBS混合物中存在混合胶束化的协同作用。
值得一提的是,在bm负值较大的系统中,获得的平衡表面活性剂组成与理想线(X1m>αOCB)存在正偏差。由于不同表面活性剂分子之间的分子间内聚力,它可以预测规则溶液理论建模线以拟合实验CMC数据。[27]
OSB/SDBS系统
在25℃下测量了不同摩尔比的单独OSB、SDBS和OSB/SDBS混合体系的表面张力。OSB/SDB(αOSB)的比率从0.2,0.4,0.6更改为0.8,总摩尔浓度固定为0.1 mol/L。图7说明了浓度与表面张力之间的关系,表4总结了表面张力参数。
表4。25℃水溶液中不同摩尔分数(αOSB)OSB/SDS体系的表面性质。
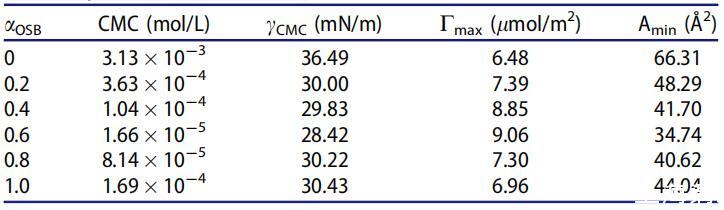
如表4所示,在混合范围内,OSB/SDBS系统的CMC和γCMC值低于单个表面活性剂的CMC和γCMC值,并且在αOSB=0.6时显示出最低值1.66*10-5 mol/L和28.42 mN/m。它起源于两种不同的表面活性剂分子之间的强相互作用,两种不同的表面活性剂分子具有相反的电荷头基团以及它们在不同烃链之间的疏水相互作用。然而,当αOSB>0.6且CMC值和γCMC增加时,单一表面活性剂的自相互作用基本上占主导地位。
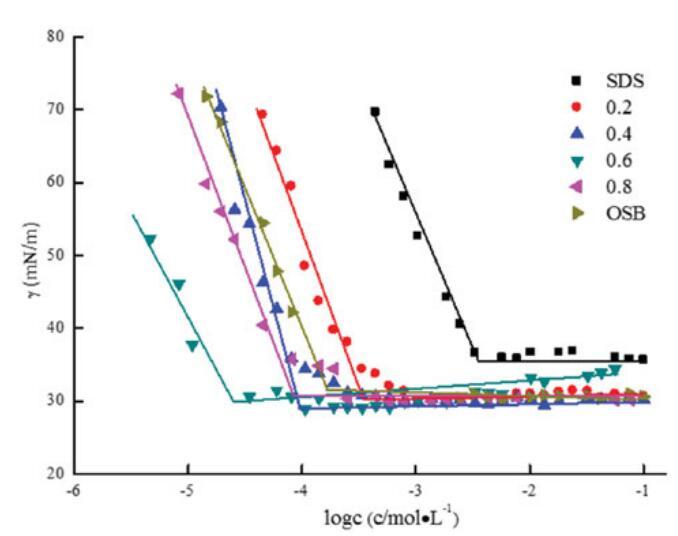
图7。不同摩尔比下单个OSB、SDS和混合OSB/SDS的表面张力与浓度对数的关系。
表4中列出的Cmax和Amin值进一步证明,两性离子/阴离子表面活性剂混合体系比各自的纯表面活性剂具有更出色的表面活性。与纯表面活性剂相比,Cmax值越大,Amin值越小,表明二元表面活性剂体系的结合越好。αOCB=0.6时,混合OSB/SDB的最大Cmax值和最小Amin值可归因于OSB和SDB在总摩尔分数内最强的吸引相互作用。
将CMC的理想值与表中的摩尔分数a和摩尔分数B绘制成表格。在OSB/SDBS混合物的情况下,在整个摩尔分数范围内,较低的实验CMC值比CMCid值可以证明由于结构差异导致的非理想混合行为。骨料中的非理想混合效应导致协同作用,并导致CMC低于仅基于未混合表面活性剂性质的预期值。
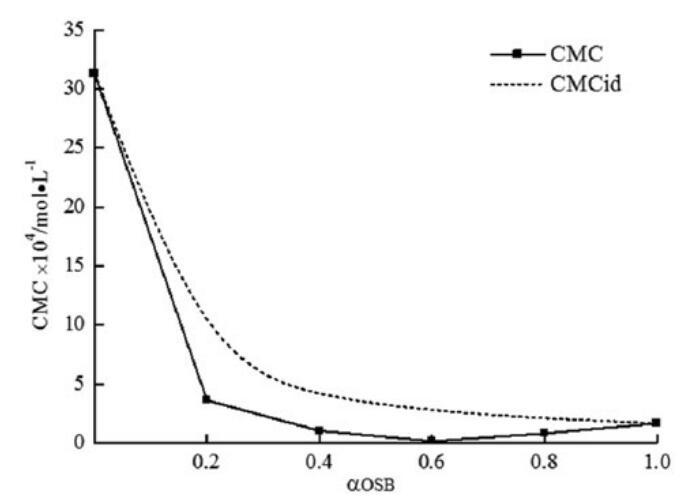
图8。研究了实验CMC、理想CMC与OSB摩尔分数的关系。
表5。25℃水溶液中不同摩尔分数(αOSB)OSB/SDS体系的非理想性及相互作用参数。

表5显示所有混合物的bm值均为负值,这意味着混合胶束中OSB和SDB之间存在有吸引力的相互作用,很明显jbmj值高于jln(CMC1/CMC2)j值。因此,OSB/SDBS系统在OSB的所有摩尔分数下表现出明显的协同作用,并且在αOSB=0.6时表现出最显着的协同作用。
在bm负值较大的系统中,获得的平衡表面活性剂组成与理想线(X1m>αOSB)存在正偏差。由于不同表面活性剂分子之间的分子间内聚力,它可以预测规则溶液理论建模线以拟合实验CMC数据。
此外,我们还比较了OCB/SDBS和OSB/SDBS系统的计算bm值。由于在二元表面活性剂体系中,bm的较大负值有利于混合胶束的形成,一般认为OSB/SDBS混合物中的协同作用程度大于OCB/SDBS混合物中的协同作用程度。
无机盐对两性离子/阴离子表面活性剂混合体系表面活性的影响
通过表面张力测量实验测定了无机盐(NaCl和MgCl2)对混合OCB/SDBS和OSB/SDBS系统中表面活性的影响,如图9和图10所示。每个混合体系的表面活性剂总浓度为0.1 mol/L,两个体系的摩尔分数分别固定为αOCB=0.6和αOSB=0.6,其中混合物表现出最强的协同作用。无机盐的浓度从0 wt%改变到0.2 wt%。
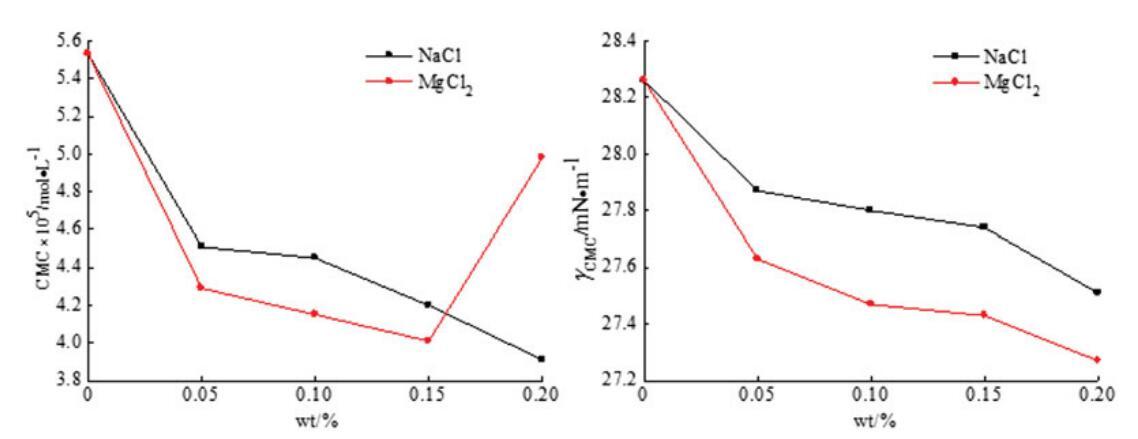
图9。无机盐(NaCl和MgCl2)对OCB/SDS体系中表面活性的影响。
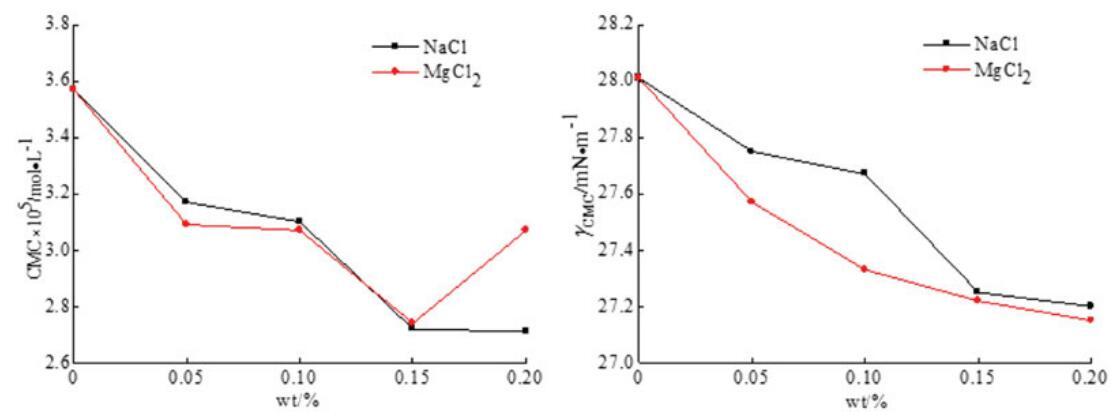
图10。无机盐(NaCl和MgCl2)对OSB/SDS系统中表面活性的影响。
从图9和图10可以看出,二元表面活性剂混合物的CMC值通常随着无机盐浓度的增加而降低,并且在添加无机盐后,两个混合体系的γCMC值降低。结果表明,在两性离子/阴离子表面活性剂混合体系中,无机盐的应用可以减少带电胶束之间的排斥作用,促进混合胶束的形成。因此,无机盐有助于促进胶束的生长和增强表面活性。此外,与单价金属离子NaCl相比,含有二价金属离子MgCl2的无机盐具有稍好的表面活性效果。二价金属离子比一价金属离子带更多电荷,更能接近混合胶束,减少二元体系中带电胶束之间的排斥。[28]因此,MgCl2在增强混合表面活性剂体系的表面活性方面更有效。然而,随着MgCl2浓度的进一步增加,CMC值略有上升。这可能是因为浓度过高的金属离子会在水溶液中的带电胶束之间引发松散的静电吸附,并导致表面活性降低。
结论
研究了橄榄油两性表面活性剂与阴离子表面活性剂(OCB/SDBS和OSB/SDBS)的表面性质及其协同作用。我们得出结论,两性离子表面活性剂和阴离子表面活性剂之间的强吸引相互作用导致空气/水界面上的分子排列更紧密,并可归因于混合胶束的形成。因此,OCB/SDBS和OSB/SDBS混合物在所有研究摩尔分数下的表面活性均高于各自的组分。根据CMC与CMCid的偏差,发现混合甜菜碱/sdb在整个摩尔分数内存在明显的非理想混合行为。对于非理想表面活性剂混合物,bm值为负值,且在每个摩尔分数下jbmj>jln(CMC1/CMC2)j。这些条件表明OCB/SDBS和OSB/SDBS系统在整个组成范围内存在明显的协同作用。此外,根据最小bm值确定了最强吸引相互作用的最佳组成,αOCB=0.6和αOSB=0.6。无机盐NaCl和MgCl2可提高混合表面活性剂溶液的表面活性,且CMC和γCMC值一般随无机盐含量的增加而降低。此外,MgCl2对混合物的表面能力效应略好于NaCl,因为二价金属离子更能减少二元体系中带电胶束之间的排斥作用。
披露声明
作者没有报告潜在的利益冲突。
基金
感谢国家自然科学基金(21676003)、北京市科技计划(Z17110013131715)、中国国家重点研究项目(2017YFB0308701)、中国北京市教育委员会科技计划重点项目(KZ2015100110)科技成果转化促进计划项目(PXM2016_014213_000028)。










