合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 氢氧化钠用量对重烷基苯磺酸钠水溶液/油体系界面张力的影响(二)
> 氢氧化钠用量对重烷基苯磺酸钠水溶液/油体系界面张力的影响(一)
> 3种不同变质煤样经湿法超细粉碎后煤颗粒表面张力变化(二)
> 3种不同变质煤样经湿法超细粉碎后煤颗粒表面张力变化(一)
> 全自动表面张力仪在铅锌矿悬浮液雾化效率分析中的应用(二)
> 全自动表面张力仪在铅锌矿悬浮液雾化效率分析中的应用(一)
> 微通道流动沸腾中表面张力的关键作用机制研究(三)
> 微通道流动沸腾中表面张力的关键作用机制研究(二)
> 微通道流动沸腾中表面张力的关键作用机制研究(一)
> 电场电压对明胶液滴荷质比、表面张力的影响及预测模型构建(三)
牛血清白蛋白对表面的影响离子液体型双子表面活性剂的性质——摘要、介绍
来源:上海谓载 浏览 2221 次 发布时间:2021-11-24
摘要
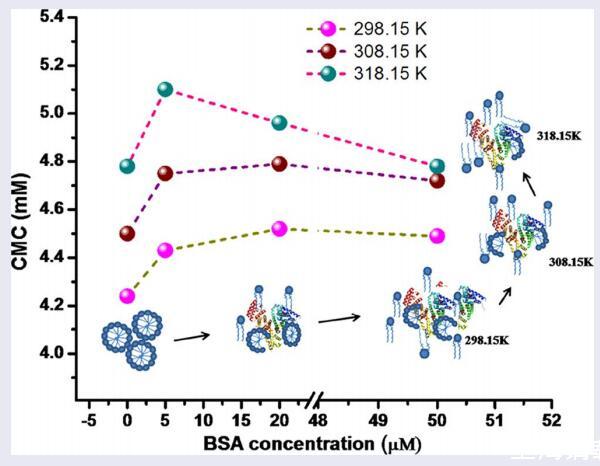
用表面张力法研究了牛血清白蛋白对IL型gemini表面活性剂[C10-4-C10im]Br2表面性质的影响。研究了不同温度下临界胶束浓度(CMC)与BSA浓度的关系。[C10-4-C10im]Br2的CMC随着BSA浓度的增加以及系统温度的升高而增加。界面参数,即;计算了最大表面过量浓度(Γmax)、每分子最小面积(Amin)和CMC下的表面压力(ΔCMC)。此外,利用表面张力数据评估了吸附和胶束化的热力学参数。结果表明,[C10-4-C10im]Br2与BSA的结合是自发的、放热的。该过程是熵驱动的,疏水相互作用是主要驱动力。
图形摘要
1.介绍
表面活性剂是由亲水性和疏水性基团组成的两亲性物质,具有自聚集(胶束化)特性。由于它们能够溶解水中的难溶物质,因此在制药科学中发挥着重要作用。[1]它们已广泛用于蛋白质折叠/去折叠和配体-蛋白质相互作用研究。例如,传统的单链表面活性剂;十六烷基三甲基溴化铵和十二烷基硫酸钠已被广泛用于血清白蛋白的折叠、变性和结合分析。[2-10]最近,gemini表面活性剂因其在以下各个领域的广泛应用而备受关注:生物化学、制药和化妆品等。双子表面活性剂属于一类新型表面活性剂,在同一分子中含有两个亲水性头基、两个疏水性尾基和一个间隔基。[11]双子表面活性剂的这种特殊设计使其优于传统的单链表面活性剂。gemini表面活性剂中存在两个疏水链和两个头部基团,使其CMC值较低,具有比传统表面活性剂更好的润湿、起泡、分散和乳化性能。[12–14]gemini表面活性剂的一个特点是,可通过改变其结构元素来调节其性能(疏水尾、亲水头基团和间隔物)。[15]另一个吸引人的特点是,与传统表面活性剂相比,较低数量的双子表面活性剂足以产生相同的效果,因此,双子表面活性剂被称为绿色表面活性剂。与传统表面活性剂一样,双子表面活性剂可以是阴离子、阳离子、非阴离子或两性离子,具体取决于其性质gemini表面活性剂由于其可调特性,能够与不同类型的分子和生物大分子(DNA和蛋白质)相互作用。[16-18]它们被用作纳米颗粒合成的封盖剂、药物和药物递送剂、基因递送剂等。[19-23]随着以双子表面活性剂为基础的技术的进步,化学家们正在不断寻找新的配方来设计具有吸引力的双子表面活性剂。离子液体(IL)基于离子液体的双子表面活性剂就是这种新型双子表面活性剂的一个例子。由于离子液体的离子性质,基于离子液体的双子表面活性剂在许多领域具有特殊的性质和潜在的应用。与传统表面活性剂相比,离子液体的双子表面活性剂具有较高的热稳定性、可忽略的蒸汽压、较高的溶解能力和极性,粘度,溶剂相容性和密度。[24,25]ILs[26]和gemini表面活性剂[27-31]发现当使用到最佳浓度范围时,可增加蛋白质的稳定性。此外,咪唑环的存在为基于IL的gemini表面活性剂增加了一些附加功能,使其比传统表面活性剂更为有益。咪唑头基团的明显极化率增加了自聚集IL型gemini表面活性剂的密度,从而使其能够作为制备功能材料的超分子模板。[32,33]具有大咪唑头基团的阳离子反胶束显示出比季铵阳离子表面活性剂更高的溶质容量。[34,35]咪唑环和共表面活性剂之间的强大吸引力促进了共表面活性剂在(w/o)界面上的固定。因此,由于咪唑头基团和芳香环之间通过π–π相互作用的强大吸引力[37],它们可以形成致密的膜[36],这在生物学上具有潜在的应用[38]最近,我们通过表面张力法研究了AMT对不同摩尔分数的IL型咪唑gemini表面活性剂界面性质的影响。[39]
也有报道称,IL型双子表面活性剂不仅比对应的单体表面活性剂与蛋白质的相互作用更强,而且比其他具有相同疏水链的常规表面活性剂更强。[40]相反,我们还发现,与单链表面活性剂相比, gemini表面活性剂表现出较弱的相互作用,并对溶菌酶产生更稳定的作用。[41]在我们以前的出版物中,我们报告了gemini表面活性剂和ILs对球状蛋白质和肽构象稳定性的影响。[42–48]发现弱相互作用,如氢键、静电、, 范德沃尔相互作用和疏水力是这些表面活性剂与蛋白质结合过程中最常见的相互作用。 我们已经观察到,根据蛋白质的结构和动力学,ILs与蛋白质表现出不同的结合行为。 gemini表面活性剂与血清白蛋白、核糖核酸酶Sa、核糖核酸酶A和溶菌酶结合作用的研究表明,gemini表面活性剂与蛋白质的相互作用取决于它们之间的静电和疏水作用的贡献, 间隔区的长度和蛋白质表面上疏水电荷的分布。[49-52]
据报道,IL型双子表面活性剂和蛋白质都有带电荷基团和疏水部分,[53,54]它们通过某种复杂的相互作用相互作用,进而影响表面活性剂和蛋白质的性质。 从文献中我们了解到,已经进行了大量的研究,主要集中在表面活性剂结构对蛋白质稳定性的影响,然而,蛋白质对IL基gemini表面活性剂界面性质的影响很少被研究。 从药学的角度来看,有必要研究蛋白质对表面活性剂的物理化学和热力学性质的影响,因为其性质的微小变化可以改变表面活性剂的功能。 我们之前已经使用光谱技术描述了IL型双子表面活性剂1,4-双(3-十二烷基咪唑-1-基)丁烷溴与溶菌酶的可能相互作用。[55]在本研究中,我们报告了BSA对离子液体型双子表面活性剂1,4-双的界面和热力学性质的影响 (3-癸基咪唑-1-基)丁烷溴([C10-4-C10im]Br2)。在本研究中,我们选择BSA作为模型蛋白,因为其结构和物理化学性质已得到很好的表征。[56,57]它是一种带负电的球状蛋白,由583个氨基酸残基和17个二硫键组成。[56,58] BSA是一种与HAS具有70%序列相似性的同源蛋白质,因此,它被广泛用作研究配体-蛋白质相互作用和筛选新合成化合物对蛋白质的影响的蛋白质模型。BSA是一种富含螺旋的蛋白质,其中α-螺旋、环和二硫键以蛋白质获得的方式结合 心形3D结构。[59]BSA由三个同源结构域组成:I、II和III。每个结构域进一步细分为两个亚结构域a和B。[60]亚结构域IIA和IIIA是疏水性的,作为主要结合位点。[61] BSA具有固有荧光探针,这使光谱技术能够用于研究配体-蛋白质相互作用。BSA具有两个色氨酸残基,即疏水配体的主要结合位点子域IIA中的Trp-212和子域IA中的Trp-134。酪氨酸残基(Tyr-263) 也存在于亚结构域IIA中。[62]因此,可以借助生物物理技术轻松分析亚结构域IIA中配体的结合。计算了不同浓度BSA下[C10-4-C10im]Br2的界面和热力学参数,以确定BSA对蛋白质的浓度依赖效应 [C10-4-C10im]Br2。此外,在不同温度下进行研究,以了解温度变化是否对[C10-4-C10im]的界面性质有任何影响 本研究将广泛了解蛋白质如何影响双子表面活性剂的界面性质,并可能有助于扩大双子表面活性剂在药物传递中的应用。
牛血清白蛋白对表面的影响离子液体型双子表面活性剂的性质——摘要、介绍
牛血清白蛋白对表面的影响离子液体型双子表面活性剂的性质——材料和方法
牛血清白蛋白对表面的影响离子液体型双子表面活性剂的性质——结果和讨论
牛血清白蛋白对表面的影响离子液体型双子表面活性剂的性质——结论、致谢!










