合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 长庆油田陇东地区的CQZP-1助排剂表/界面张力测量及现场应用(三)
> 长庆油田陇东地区的CQZP-1助排剂表/界面张力测量及现场应用(二)
> 长庆油田陇东地区的CQZP-1助排剂表/界面张力测量及现场应用(一)
> 液膜断裂点与电压最大值在表面张力测量中的对比研究(二)
> 液膜断裂点与电压最大值在表面张力测量中的对比研究(一)
> 表面张力与表面张力系数测量:概念、方法与科学意义
> 微重力下二极对非均匀旋转磁场控制半浮区液桥表面张力对流的数值研究(下)
> 微重力下二极对非均匀旋转磁场控制半浮区液桥表面张力对流的数值研究(上)
> 胆汁酸通过改变肺泡表面张力调节呼吸功能的机制研究——讨论、结论、展望
> 胆汁酸通过改变肺泡表面张力调节呼吸功能的机制研究——结果
LB膜-石墨烯与磷脂之间的作用【上】
来源:上海谓载 浏览 2160 次 发布时间:2022-07-25
摘要
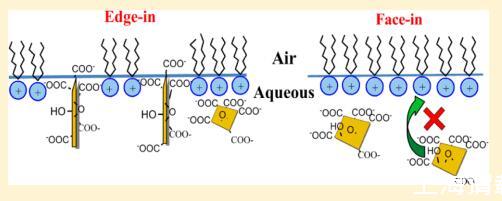
氧化石墨烯在生物医学领域有着广泛的应用前景。但关于GO如何与细胞膜或模型系统相互作用的信息仍然非常有限。当GO与脂质相互作用时,它是如何定位自身的还不清楚。在本研究中,朗缪尔单层技术应用于空气中−研究GO和脂质模型之间相互作用的性质和方向的水/水界面。故意选择具有相同18碳烷基链但不同电荷头基的五种脂质(DODAB、DSEPC、DSPC、DSPA和SA),以合理化可能的相互作用。实验结果表明,这种相互作用是由极性头群和GO之间的静电相互作用决定的。GO可以并入带正电的脂质DODAB和DSEPC的单层,但不能并入带中性或带负电的脂质(DSPC、DSPA和SA)。将GO注入荷正电脂质DODAB和DSEPC单层下方的亚相时,观察到不同的表面压力行为。提出了一个“边入”而不是“面入”的取向模型来解释GO在DODAB单分子膜上的吸附。
引言
石墨烯是一种单原子厚的sp2杂化碳原子平面片,由于其新颖的光学、机械、电子学、热学和生物学特性,近年来在各种研究和应用中引起了极大的关注。1,2氧化石墨烯(GO)具有与石墨烯类似的原子薄结构,但具有大量含氧官能团,例如边缘的羧基和基面上的羟基和环氧基。1 GO由于其特殊的物理和化学性质,例如低成本的制造工艺、丰富的胶体性质、高吸附性和通用荧光猝灭,在生物传感和生物医学领域显示出了优越的应用。3.−6过去几年中,GO或功能化GO作为一种有效的方式,将生物活性肽、蛋白质、核酸等治疗分子输送到抗癌药物中,取得了巨大进展。4,7,8 GO也可用于生物传感,3,9成像,10−12实时监测蛋白酶活性,13,14和近红外光热治疗癌症和阿尔茨海默病。15−17
GO在生物系统中的应用需要解决GO和细胞成分(如膜)之间可能存在的相互作用。膜是自然的二维屏障,将细胞的内部环境与外部环境物理隔离。磷脂作为细胞膜的主要结构成分,参与各种生物反应,如细胞粘附、离子电导率、疾病相关反应以及信号和物质的传输。18之前的研究已经报道GO可以应用于细胞成像以及药物和基因传递,表明它可能进入细胞。8,10,11但是关于GO如何与细胞膜或模型系统相互作用的研究仍然非常有限。19关于GO的细胞毒性及其进入细胞膜的方式也得到了不一致的结果。20,21此外,与球形或管状纳米材料相比,GO是一个非常薄的层(∼1 nm),具有较大的表面积和不规则形状。1当GO与细胞膜相互作用时,它是如何定位自身的尚不清楚。因此,了解GO和各种脂质模型之间相互作用的性质至关重要。这些知识可以为GO在生物和生物医学领域的未来应用提供进一步的信息。
除了GO在生物传感和生物医学研究中的应用外,使用GO和其他一些组件构建和组织介观或宏观定义良好的复合材料已被证明是制备电子器件的简单而有用的方法,例如超级电容器电极、导电聚合物和场效应器件。22−24因此,理解和操纵GO和复合材料中其他组件之间的相互作用、方向和结构控制对于潜在的制造和应用至关重要。
朗缪尔单层和朗缪尔−空气中的Blodgett(LB)膜−水/水界面是典型的二维表面化学方法,广泛应用于空气中两亲分子的结构和性能研究−水/水界面,如蛋白质和脂质。25−27这些方法的一个显着特点是从分子水平对层结构进行内在和精确的控制。由于GO薄片边缘的羧基脱质子化,带负电的GO和带电荷的脂质之间预计会发生22,28静电相互作用。空气−水/水界面有望成为研究脂质和GO之间相互作用的理想场所,因为两亲性脂质很容易在界面上定向,极性/带电基团合并在亲水水相中,而非极性部分朝向空气相。
在本研究中,为了理解和定义GO和具有不同头群的脂质模型之间相互作用的性质和方向,在空气中应用了Langmuir单层技术−表征水/水界面的性质,如分子堆积、吸附和偶极矩。选择具有相同烷基链长度(18个碳)但不同电荷和头基的五种脂质来合理化可能的相互作用。本研究中使用的脂质的所有烷基都有目的地选择为具有18个碳链,以消除末端烷基的可能影响,如图1所示−用原子力显微镜(AFM)将Blodgett薄膜转移到基底上,进一步表征单层的形貌。
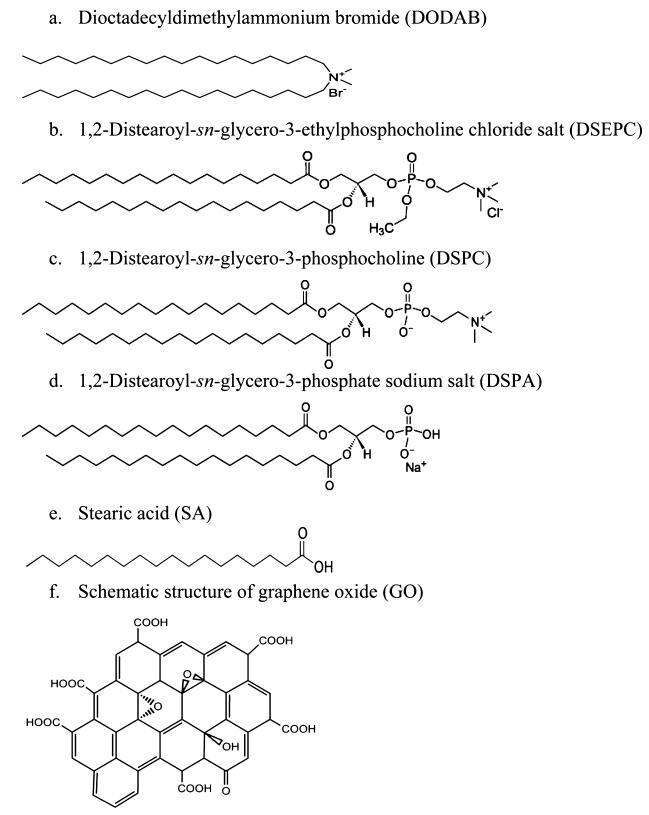
方案1.脂质和氧化石墨烯的化学结构
实验部分
正电荷脂质二十八烷基二甲基溴化铵(DODAB)和1,2-二硬脂酰-sn-甘油-3-乙基磷酸胆碱氯化盐(DSEPC)、中性电荷两性脂质1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(DSPC)和负电荷脂质1,2-二硬脂酰-sn-甘油-3-磷酸钠盐(DSPA)购自Avanti Polar Lipides(Alabaster,AL)。硬脂酸(SA)购自SigmaAldrich(密苏里州圣路易斯)。由于头部基团中存在阴离子磷酸盐和阳离子季铵中心,DSPC带中性电荷,如方案1c所示。由于羧基脱质子化,SA被认为是带负电的分子。所有这些脂质在非极性尾部都有18个碳链烷基。光谱级氯仿和甲醇来自MP Biomedicals(Solon,OH)。单层GO购自ACS Material LLC(马萨诸塞州梅德福德)。所有这些化学品均未经任何进一步净化。化学结构如图1所示。实验中使用的去离子水来自Modulab 2020水净化系统(德克萨斯州圣安东尼奥)。去离子水的电阻率、表面张力和pH值在20.0±0.5°C时分别为18 MΩ·cm、72.6 mN/M和5.6。所有实验均在恒温20.0±0.5°C、湿度50±1%的洁净室(1000级)中进行。
通过向10 mg GO中添加10 mL去离子水,然后在冷水浴中超声1小时,获得1 mg/mL GO水分散体(Branson,1510型,丹伯里,CT)。通过用去离子水稀释制备0.01、0.02和0.04 mg/mL GO分散体。我们之前已经证明,单层GO是使用相同的材料和程序通过UV获得的−可见光谱和原子力显微镜(AFM)。6张AFM图像显示,去角质GO的高度约为1 nm,而横向尺寸高达几百纳米。将除DSPA外的每种脂质溶解在氯仿中,以获得约0.3 mg/mL的浓度。少量脂质:氯仿溶液(25至45μL)在空气中逐滴沉积−水或空气−GO分散(0.01、0.02和0.04 mg/mL)界面,使用100μL注射器(Hamilton Co.,Reno,NV)。由于DSPA不完全溶于氯仿,因此使用氯仿:甲醇:水=65:35:8(体积比)的混合溶剂溶解DSPA。在整个表面化学测量过程中,使用面积为5.9 cm×21.1 cm的Kibronμ-槽S(Kibron Inc.,芬兰赫尔辛基)。表面压力用合金丝探头监测,表面电位用开尔文探头监测。当DSEPC参与实验时,值得注意的是,使用一块干净的薄玻璃片覆盖两个特氟隆势垒的内表面,以防止DSEPC和特氟隆势垒之间的任何相互作用。等待15分钟,蒸发挥发性溶剂,使朗缪尔单层达到平衡。为了吸附GO到脂质Langmuir单层,在将单层压缩到一定的表面压力后,在单层下方注入0.6 mL 1 mg/mL GO分散液,使GO达到0.02 mg/mL,然后在恒定区域监测表面压力和表面电位随时间的变化。
朗缪尔−Blodgett(LB)薄膜是通过以1 mm/min的恒定速度从亚相垂直拉出一块新切割的V-1级云母片(宾夕法尼亚州哈特菲尔德的电子显微镜科学公司)获得的。在成像之前,将转移的薄膜在空气中干燥几个小时。原子力显微镜(AFM)图像是使用安捷伦5420 AFM仪器(加利福尼亚州圣克拉拉)以轻敲模式拍摄的,分辨率为512×512像素。悬臂梁的共振频率为∼170 kHz,典型力常数为7.5 N/m,无涂层硅探头。
结果和讨论
表面压力−脂质在空气中的面积等温线−GO水分散体界面。表面压力定义为纯水表面和单层覆盖表面之间的表面张力降低。它描述了空气中的分子堆积密度−水或空气−水界面。表面压力−面积等温线是通过监测表面压力变化与平均分子面积在恒定温度下压缩过程中获得的。当分子在崩塌前紧密堆积时,通过外推表面压力的线性部分得到的面积−表面压力为零(如图1a中的虚线所示)的面积等温线(固相或液凝聚相)被称为极限分子面积。29这一重要特征代表了分子紧密堆积在单层中时所占的平均分子面积。极限分子面积通常由头基的分子间相互作用和烷基链的堆积决定。30
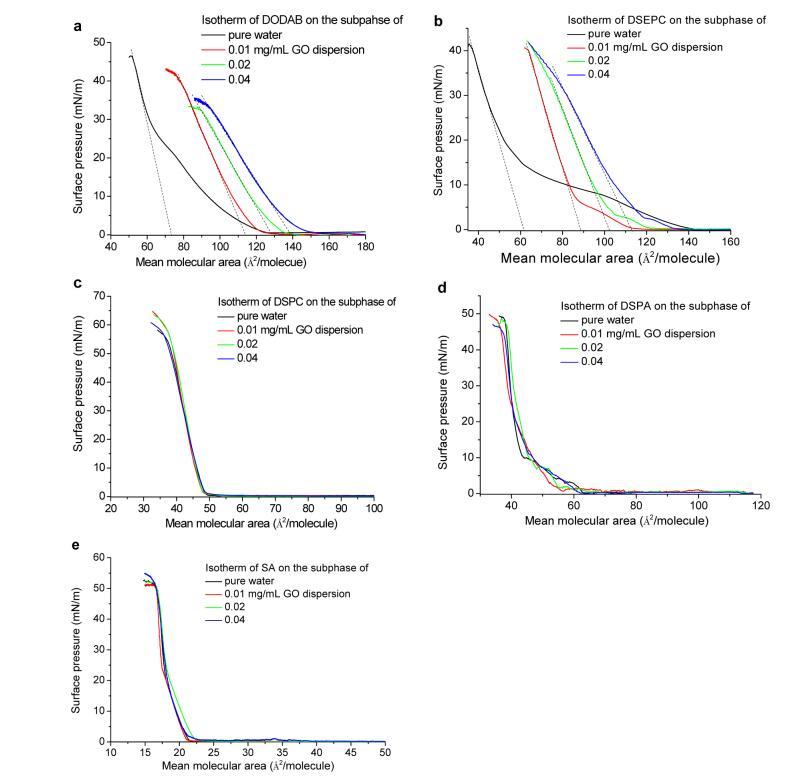
图1.表面压力−脂质在空气中的面积等温线−水或GO分散界面:(a)带正电的DODAB;(b)带正电的DSEPC;(c)中性充电DSPC;(d)负电荷DSPA;(e)带负电的SA。请注意,在空气中未检测到表面压力−进入分散界面,不要在界面上分散脂质。带有每个分子轴面积的虚线截距表示每个分子的极限面积。
图1显示了表面压力−纯水和GO水分散体亚相(0.01、0.02和0.04 mg/mL GO)上带正电的DODAB(a)和DSEPC(b)、带中性电荷的DSPC(c)、带负电的DSPA(d)和SA(e)的面积等温线。
值得注意的是,使用0.01、0.02和0.04 mg/mL GO水分散体作为亚相,在界面处未检测到表面压力,而不扩散脂质(数据未显示),这表明本研究中使用的GO本身的表面活性不足以影响水的表面张力。纯水子相上带正电的DODAB和DSEPC的极限分子面积分别为73和61Å2/分子,如图1a、b中黑色曲线上的虚线所示。这些数字与之前的研究一致。30−32当这两种脂质沉积在空气中时−在GO分散界面,随着亚相GO浓度从0.01增加到0.02到0.04 mg/mL,可以清楚地观察到极限分子面积的增加。此外,随着GO浓度的增加,液体凝聚相开始于更高的平均分子面积。这一观察表明,GO可以结合或吸附到DODAB和DSEPC的单层中,增加平均分子面积。然而,当沉积带中性电荷的脂质DSPC、带负电的脂质DSPA和脂肪酸SA时,表面压力−流动分散时的面积等温线几乎与纯水子相上获得的等温线完全相同,如图1c所示−e、在这三种分子的每种情况下,表面压力在几乎相同的平均分子面积下升高,并且极限分子面积也非常相似,尽管在亚相中GO的浓度不同。这些观察结果表明,GO不能并入或吸附到DSPC、DSPA或SA的单层中。界面和亚相的GO的存在对这些分子的单层形成没有任何影响。由于细胞膜中的磷脂带负电荷或中性电荷,细胞可能将GO摄取到膜中不应是由于GO和磷脂之间的直接化学相互作用,而是通过生物过程,如内吞作用。8,33
图1清楚地表明,具有不同电荷的头部基团对脂质和GO之间的相互作用有着深远的影响。人们认为疏水性尾部基团不参与这种相互作用。这是因为18碳疏水尾应朝向疏水空气相。即使尾巴可以与GO在空中接触−在沉积后的水界面上,在压缩过程中未观察到对DSPC、DSPA和SA等温线的提升面积或极限分子面积的影响。特别值得注意的是,DSEPC、DSPC和DSPA具有完全相同的1,2-二硬脂酰-sn-甘油基团,只是与头部基团不同,如方案1b所示−d、因此,控制GO和脂质相互作用的因素是头部。带正电的头基(铵和乙酰胆碱)与GO带负电的羧基具有强大的静电吸引力,导致GO并入单层。由于不利于静电相互作用,带中性电荷的头基(磷酸胆碱)或带负电荷的头基(磷酸和羧基)不吸附GO。此外,这些带中性电荷和带负电的头群似乎可以将围棋从空中击退−GO色散界面。这解释了为什么这些脂质在GO分散上的等温线与在纯水亚相上的等温线几乎完全相同。因此,我们将在下面的讨论中重点讨论GO和DODAB以及DSEPC之间的相互作用。










