合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(四)
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(三)
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(二)
> 聚合物稠化剂(ASCM)合成条件、界面张力及耐盐、耐剪切性能(一)
> 新型多羟基苯磺酸盐驱油剂的界面张力优化及油田应用潜力分析(三)
> 新型多羟基苯磺酸盐驱油剂的界面张力优化及油田应用潜力分析(二)
> 新型多羟基苯磺酸盐驱油剂的界面张力优化及油田应用潜力分析(一)
> 基于最大气泡压力方法测量液态锂锡合金表面张力
> 烷基糖苷表面活性剂界面张力与润湿性相关性研究(二)
> 烷基糖苷表面活性剂界面张力与润湿性相关性研究(一)
酯功能化的双子表面活性剂与血红蛋白的结合——结果和讨论
来源:上海谓载 浏览 2334 次 发布时间:2021-11-15
三、结果和讨论
3.1. 表面张力测量
表面张力测量用于研究 关于 16-E2-16/Hb 相互作用的定性信息 空气/水界面。 图 1 显示了 16-E2-16 分布的表面张力与对数浓度在不存在和 在不同温度下存在 Hb (5 μM)。 断点 表面张力与表面活性剂浓度对数的关系 不同温度下纯表面活性剂的文件对应 到相应温度下表面活性剂的 cmc。 这 16-E2-16/Hb体系的表面张力曲线呈现两个断裂 点,第一个断点对应临界聚合 浓度(cac)代表表面活性剂的开始 蛋白质结合而作为第二个断点对应于 在 Hb 存在下 16-E2-16 的 cmc。 16-E2-16 的 cmc 在不同温度下不存在和存在 Hb 的情况下 列在表 1 中。从这些值可以看出,16-E2-16 的 cmc 随着 Hb 的存在和温度升高而增加。 在 Hb 存在下 cmc 的增加证实了 16-E2-16/Hb 复合物的形成,在此期间一些单体 与 Hb 结合,因此无法形成胶束 进而导致胶束化延迟 [54]。 表1还 表明 cmc 值随温度升高而增加 这意味着疏水力的参与,它们是 温度依赖,在 cmc 的蛋白质表面活性剂相互作用中。 这可以归因于 16-E2-的溶解度增加 16 单体随温度变化而抑制胶束化。 此外,较高的温度有利于热运动,这会导致 更多的分子与 Hb 结合。 但是,cac 保持不变 在所有温度下。 因此,我们可以认为 16-E2-16 与 Hb 结合 通过 cac 附近的静电相互作用,因为静电 相互作用不受温度影响。 此后,作为 表面活性剂浓度增加,蛋白质通过疏水力与表面活性剂相互作用。 下表面张力值 Hb-16-E2-16系统比对应的16-E2-16系统是 由于 Hb 的高表面活性。
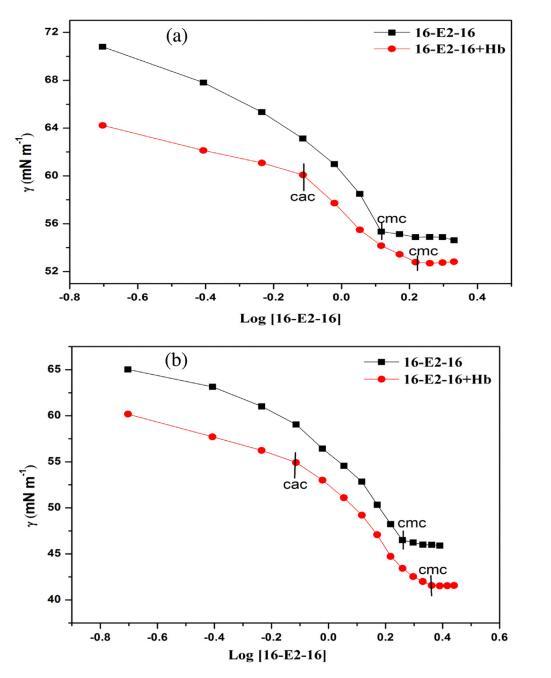
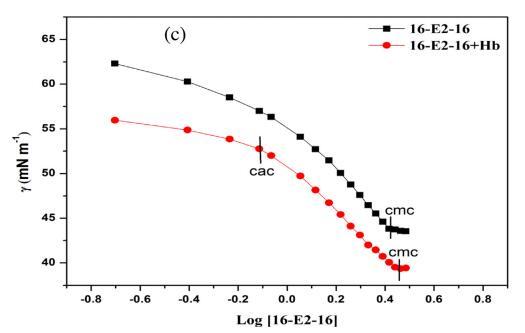
图 1. 16-E2-16/Hb 在不同温度下的表面张力。 (a) 298.15K (b) 308.15K (c) 318.15K。 [Hb] = 5 μM。
3.1.1. 界面参数
最大表面过量 (∫max) 表示为每单位面积界面处的表面活性剂分子浓度。 表面张力数据用于计算表面过量 应用吉布斯吸附等温线的浓度 (∫max) 方程:

其中 γ 是表面活性剂浓度 C 下的平衡表面张力 (mNm−1),n 是每分子的粒子数 表面活性剂。 由于表面活性剂的解离导致三种物质的形成,公式 1111 表示在低于 cmc 的恒定温度下 γ 与 log[16-E2-16] 之间的曲线斜率。 ∫max 值允许计算 每个分子 Amin 的最小表面积(以 nm2 为单位) 方程:

表格1 不同温度下 Hb 不存在和存在时 16-E2-16 的 cmc、∫max 和 Amin
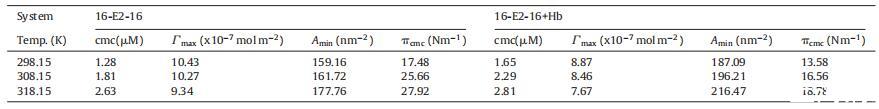
其中 NA 是阿伏伽德罗数。 为 ∫max 获得的数据 和 Amin 列于表 1。发现 ∫max 值为 16- E2-16 随温度升高而降低,表明 系统涉及静电和疏水相互作用[55]。 Amin 值随温度升高而增加 正如分子运动增加所预期的那样 [56]。 ˘cmc ,其定义为表面活性剂降低表面张力的有效性,测量为 cmc 处的表面压力 [57],和 从关系计算:

其中γ o 和γ cmc 是指溶剂体系的表面张力 (水/水 + Hb) 和 cmc 值下溶液的表面张力。
3.1.2. 热力学参数
离子表面活性剂在水溶液中胶束化的热力学参数可以借助 以下方程使用质量作用模型胶束化 [58]

其中αG0m、αH0m和αS0m是自由能、焓的变化 和胶束化熵,Xcmc 是 cmc 处的摩尔分数。 这 从方程 (6-8) 获得的值显示在表 2 中。
表 2 胶束化的自由能 (αG0m)、熵 (αS0m) 和焓 (αH0m) 的变化以及自由能 (αG0) 的变化 ad) 不存在和存在时 16-E2-16 的吸附 不同温度下的 Hb。
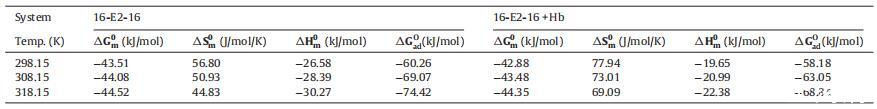
这 αG0m 在所有温度下的负值表明容易 在所研究的条件下形成胶束。 此外, αG0m 的负值随温度升高而增大 这表明16-E2-16分子在高温下脱水是胶束形成的主要因素。 这 胶束化 αH0m 的负值证实了放热 过程的性质。 获得的 αS0m 值都是正的,表明系统在转换后增加了随机性 离子表面活性剂分子变成胶束。 换句话说,我们可以 说对表面活性剂的运动有较小的阻碍 分子存在于胶束中时。
标准吸附自由能,αG0 这个系统的广告是 使用关系计算:

αG0 的值 由此获得的 ad 列于表 2 中。 吸附热力学参数αG0 广告价值全是 负且比 αG0m 更负,表明界面处的吸附与自由能的降低有关 系统的。 这可能是由于空间因子对 对胶束化的抑制作用大于对吸附作用的影响。
3.2. 紫外-可见研究
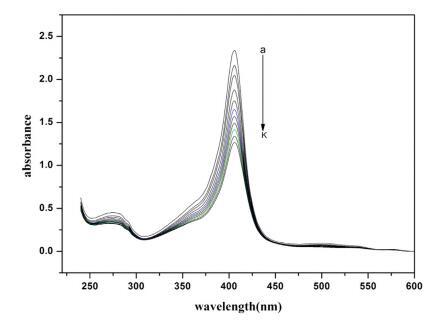
Hb 在其吸收光谱中显示三个不同的峰。 这些 是; Trp 和 Tyr 残基的苯基(273 nm), -乐队 (360 nm) 和卟啉-索雷带 (404 nm,强烈允许 - * 电子跃迁)[59,60]。 这个乐队起源于 血红素基团,嵌入由 蛋白质的骨架通过适当的折叠[61,62]。 变化 soret 吸收带的位置和强度 提供有关蛋白质在缀合过程中可能发生解折叠和变性的信息 [59,60,62,63]。 图 2 显示了 不存在和存在各种浓度的 Hb 的吸光度 16-E2-16。 添加 16-E2-16 显示出显着的 Soret 带强度的光谱变化,但峰值位置保持不变。 16-E2-16 降低强度 soret 带暗示 16-E2-16 可以访问血红素组 并直接参与扰乱结构和暴露 水介质中的血红素基团 [61]。 换句话说我们 可以说,由于蛋白质的血红素基团与 16-E2-16 的某种相互作用,Hb 经历了扰动。 血红蛋白是 由于工作 pH 值 (7.4) 较大,因此带轻微负电荷 比 Hb 的 pI (6.86) 和在这种情况下阳离子的相互作用 表面活性剂与蛋白质同时具有静电和疏水性 [64] 然而,这与表面张力结果非常吻合,van 德瓦尔斯力不容忽视。
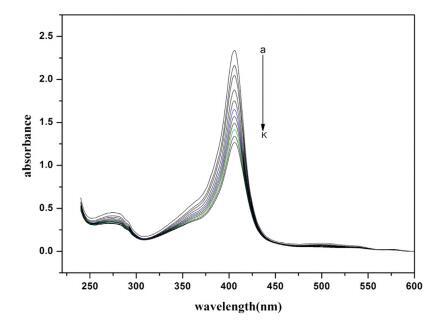
图 2. 不存在和存在 16-E2-16 时 Hb (5 μM) 的紫外-可见光谱。 这 16-E2-16 (am) 的浓度为 0, 0.39, 0.76, 1.13, 1.48, 1.81, 2.14, 2.45, 2.75, 3.05 和 3.33 μM。
3.3. 荧光光谱研究
Hb 的荧光主要是由于色氨酸和酪氨酸残基的存在。 图 3 显示了荧光光谱 Hb 不存在和存在 16-E2-16。 每个 α 和 ˇ 链中有 3 个色氨酸(α214Trp、β215Trp、β217Trp)。 根据 Rodgers 的说法,[65] Hb 的内部荧光主要是 来源于 β237Trp。 由于 Trp 和血红素都位于 在 Hb 的疏水腔中,有效的能量转移来自 Trp 到血红素显着淬灭蛋白质荧光 [66] 因此,水中 Hb 的荧光强度非常低。 当用不同量滴定固定量的 Hb 时 在 16-E2-16 中,Hb 荧光强度的增加是 观察到(图 3)表明表面活性剂分子渗透 Hb 的疏水腔并暴露血红素,从而 用血红素抑制 Trp 猝灭,从而抑制荧光 Hb 强度明显增加。 最初,荧光 强度迅速增加,但当 16-E2-16 的浓度 超过它的cmc,荧光强度缓慢增加 此后。 对这一观察结果的合理解释是 疏水腔中疏水血红素的溶解 表面活性剂胶束增加血红素之间的距离 和 trp 并以这种方式抑制了 Trp 之间的能量转移 和血红素。
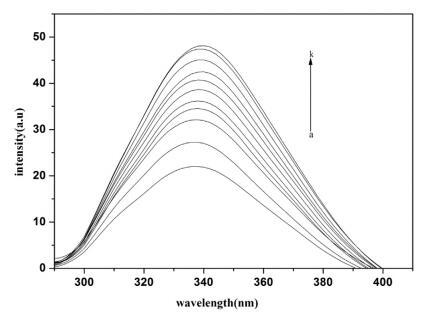
图 3. 不存在和存在 16-E2-16 时 Hb (5 μM) 的荧光光谱。 这 16-E2-16 (ak) 的浓度为 0, 0.39, 0.76, 1.13, 1.48, 1.81, 2.14, 2.45, 2.75, 3.05 和 3.33 μM。
图 4 为 Hb 的同步荧光光谱 16-E2-16 在水体系中,μ = 20 nm(图 4a)和 γ? = 80 nm(图 4b)。 当 μ= 20 nm 时,特征信息 关于Tyr,当γμ= 80 nm 时,获得关于Trp 的特征信息[67]。 从图中可以看出 Tyr 和 Trp 的荧光强度增加,荧光发射波长几乎保持不变 添加 16-E2-16。 从图 4(a 和 b)可以看出,Trp 的荧光强度增加大于 Tyr。 因此,Trp 荧光可以代表 Hb 荧光 16-E2-16/H2O 系统。
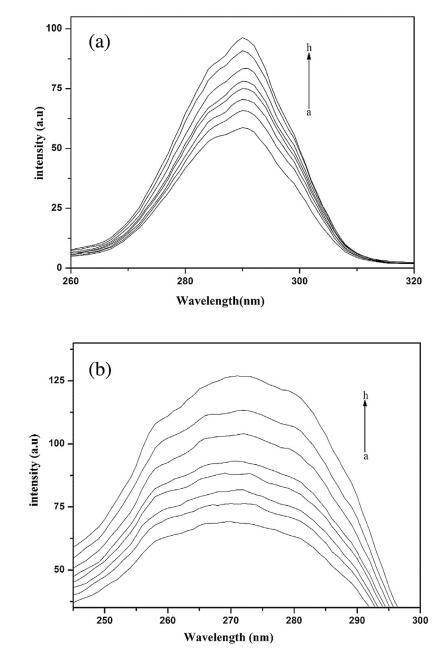
图 4. Hb (5 μM) 的同步荧光光谱。 (a) α∫= 20 nm (b) ? = 80 纳米。 16-E2-16(ah)的浓度分别为0、0.39、0.76、1.13、1.48、1.81、 2.14 和 2.45,μM。
3.4. 圆二色性
进行CD以进一步确认构象变化 由 16-E2-16 引起的 Hb,从而允许进一步评估 Hb 和 16-E2-16 之间的相互作用。 图 5 显示了 不存在和存在 16-E2-16 时 Hb 的 CD 光谱。 光盘 Hb 的光谱在 208 nm 和 222 nm 处显示两个负最小值, 蛋白质α-螺旋结构的特征。 16-E2-16 光学不活动不显示任何信号。 在场 在 16-E2-16 中,Hb 的负椭圆度降低,表明 可能形成 Hb/16-E2-16 复合物 [68]。 α-螺旋 计算了 Hb 及其与 16-E2-16 (2 μM) 复合物的百分比,发现分别为 53% 和 47%。 进一步降低 在更高浓度的 16-E2-16 (2.5 μM) 存在下达到 44% 表明 Hb 的 α-螺旋含量明显降低。 因此, CD 结果表明存在 16-E2-16 变化 Hb 的二级结构与我们的 计算结果。
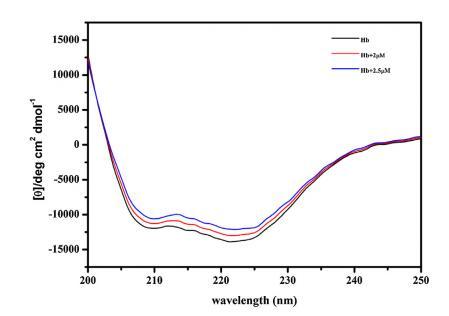
图 5. 不存在和存在 16-E2-16 时 Hb (5 μM) 的 CD 光谱。
3.5. 分子对接
Hb 中的 α 和 β 链具有相似的结构折叠, 由七个连续的α-螺旋和两条链组成 包含由螺旋 4 和 5 包围的间隙结合袋,而空腔的底部由 C 端部分形成 螺旋 6 和螺旋 7 的 N 端片段 [69]。 16-E2-16为主 Hb 与中央空腔、α1 和 β2 链结合(图 6A)。 这 该结合位点上的氨基酸残基包括 Thr39, α1 中的 Tyr42、Phe43、Pro44、His45、His58、His87、Leu91、Val93、Asn97 链和 Leu31、Arg40、Phe41、Phe42、His63、Val67、Ala70、Phe71、 His92, Leu96, His 97, Val98, Asn102, Phe103, Leu106, Leu141 in β2 链图 6B。 有超过 20 个氨基酸残基位于 16-E2-16 的站点,这意味着它们之间的强相互作用 16-E2-16 和 Hb [70]。 疏水性和静电力作用 在 16-E2-16 与 Hb 的结合中起重要作用,这个结果是 与我们的实验结果一致。 然而,范德瓦尔斯 力量不容忽视。 已观察到一个氢键 在 16-E2-16/Hb 相互作用中的 16-E2-O 原子 具有 β2 链 ARG40 的 16 个分子(图 6C)。 的形成 氢键稳定 16-E2-16/Hb 复合物。 的类型 相互作用和参与相互作用的氨基酸残基 以表格形式显示(表 3)。
表3 结合能、结合常数和活性位点残基及其与配体的相互作用类型。
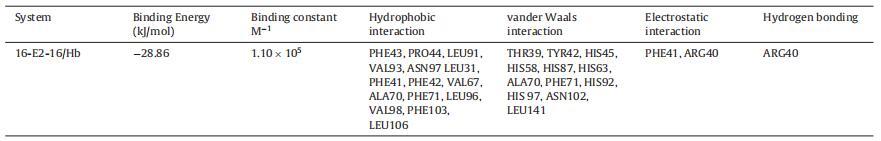
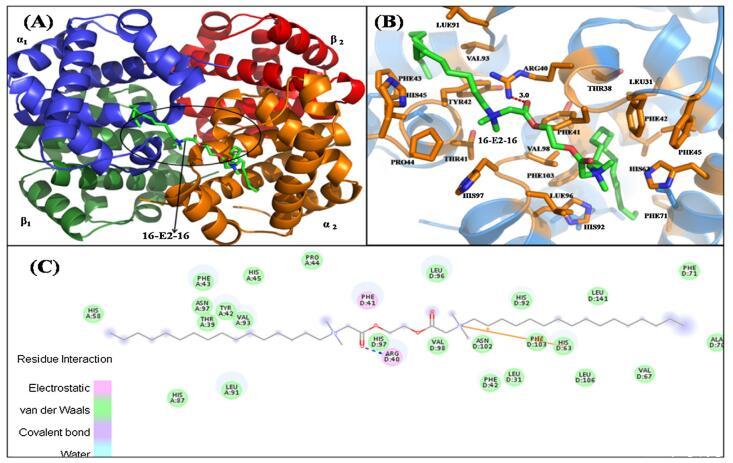
图 6. 具有 16-E2-16 的 Hb 结构示意图。 (A) Hb-16-E2-16 的结构。 Hb 的亚单位用不同的颜色表示。 配体 16-E2-16 是 以棍子为代表。 (B) 距停靠的 16-E2-16(绿色)5Å 范围内 Hb 的周围氨基酸残基(橙色)。 (C) Hb/16-E2-16 相互作用的二维表示。 (为了 对图例中颜色参考的解释,读者可参考本文的网络版本。)
3.6. 分子动力学模拟
进一步研究16-E2-16的结构稳定性影响 结合Hb,采用分子动力学模拟。 我们分析了两者的动态结构特性,例如均方根偏差 (RMSD) 和回转半径 (Rg)。 未绑定和 16-E2-16 有界 Hb 使用从获得的轨迹 MD模拟。
为了探索 Hb 的稳定性和动力学特性 绑定后,未绑定和16-E2-16有界的MD模拟 Hb 是针对 20000 ps 的模拟时间尺度进行的。 图 7(A) 显示未结合和 16-E2-16 的 RMSD 值 有界 Hb 复合物从 0 ps 突然增加到 6000 ps 并且 此后两个系统都达到平衡相并获得 在整个仿真过程中,RMSD 值稳定,波动小。 未结合和 16-E2-16 有界 Hb 的 RMSD 值 分别为 0.38 ± 0.02 和 0.34 ± 0.01 nm,在 最后 10000 ps 轨迹。 因此,很明显 16-E2-的 RMSD 值 16 有界 Hb 小于未结合 Hb。 这一结果表明 16-结合后的结构变化和复合物形成 E2-16 与 Hb 显示出与我们的 UV-vis 的良好一致性 结果 [71]。
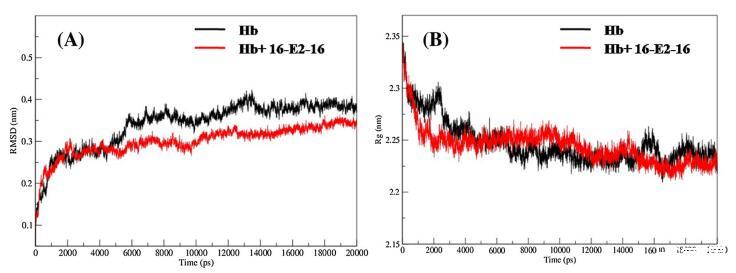
图 7. (A) RMSD 和 (B) Rg 随未结合和 16-E2-16 有界 Hb 的模拟时间的变化。
Rg 值给出了整体结构的精细测量 Hb 的维度。 未结合和 16-E2-16 有界 Hb 在模拟 20000 ps 时间尺度上计算的 Rg 值 如图7(B)所示。 该图清楚地表明,最初未结合的和 16-E2-16 有界的 Hb 具有相同的 Rg 值 (2.34 nm) 并在 4000 ps 左右达到平衡,此后为 Rg 值在整个模拟期间保持稳定,波动很小。 该 Rg 值与报告的 Hb 的 Rg 值相似 (2.37 ± 0.05 nm) 通过中子散射技术测量 水溶液[72-75],因此表明模拟结果的准确性。 达到平衡后,未结合的 Rg 值和 发现 16-E2-16 有界 Hb 为 2.22 ± 0.02 和 2.21 ± 0.02 分别在整个模拟过程中波动很小。 从 6000 到 12000 ps,16-E2-16 结合 Hb 的 Rg 值有 略有增加,而从 14000 到 20000 ps,Rg 值减少 关于未结合的 Hb。 Rg 值的这种变化表明 16- E2-16 在 Hb 中引起了一点构象变化 [68],这 与实验结果相似,与CD吻合良好 结果。










