合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 不同矿浆浓度、粒度、伴生矿物、捕收剂和起泡剂对矿浆表面张力的影响(三)
> 不同矿浆浓度、粒度、伴生矿物、捕收剂和起泡剂对矿浆表面张力的影响(二)
> 不同矿浆浓度、粒度、伴生矿物、捕收剂和起泡剂对矿浆表面张力的影响(一)
> 长庆油田陇东地区的CQZP-1助排剂表/界面张力测量及现场应用(三)
> 长庆油田陇东地区的CQZP-1助排剂表/界面张力测量及现场应用(二)
> 长庆油田陇东地区的CQZP-1助排剂表/界面张力测量及现场应用(一)
> 液膜断裂点与电压最大值在表面张力测量中的对比研究(二)
> 液膜断裂点与电压最大值在表面张力测量中的对比研究(一)
> 表面张力与表面张力系数测量:概念、方法与科学意义
> 微重力下二极对非均匀旋转磁场控制半浮区液桥表面张力对流的数值研究(下)
不同膜压下钙诱导的磷脂排序研究——结果和讨论
来源:上海谓载 浏览 2071 次 发布时间:2022-06-22
结果和讨论
首先,给出了从表面压力测量中获得的压缩等温线,揭示了水、钠和钙溶液中脂质单层之间的宏观差异。然后,我们使用荧光显微镜沿着压缩等温线观察了结构域的形成,并跟踪了当Ca2+离子结合到单层时结构域的变化。最后,利用VSFG在分子水平上阐明了阳离子-脂质相互作用。
压缩等温线。图2显示了DPPC和DMPS单分子膜在不同亚相(净水、1 M NaCl和1 M CaCl2溶液)上的Langmuir等温线。对于此处使用的1 M NaCl和1 M CaCl2溶液,亚相中的氯离子浓度不同。由于氯离子与磷脂的配位作用较弱,因此可以忽略因氯离子浓度不同而产生的11种可能影响,这已通过使用0.5 M CaCl2溶液的对照实验得到证实。
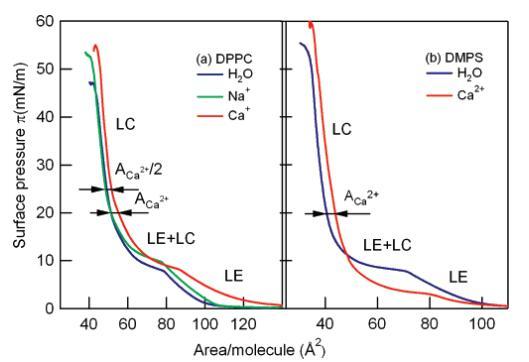
图2:DPPC(A)和DMPS(b)在不同亚相上的压力面积(π-A)等温线:净水(蓝色)、1 M NaCl溶液(绿色)、1 M CaCl2溶液(红色)。沿等温线显示了液相膨胀相(LE)、液相凝聚相(LC)和两相共存区(LE+LC)。ACa2+代表钙离子的面积。
在水上,DPPC的相行为已被充分记录。23,25随着表面积的减小,已确定以下区域:气相、液相膨胀(LE)相、LE和液相冷凝(LC)相共存的平台特征以及纯LC相。
由于亚相中存在钠离子,DPPC的压缩等温线在LE和LE+LC区域移动到略高的表面压力。之前也观察到了同样的效果30,这可以通过离子结合到LE相引起的脂链紊乱来解释。在较高的表面压力下,钠对压缩等温线没有影响,表明钠离子与LC相没有明显的相互作用:离子可能正从头群区域“挤出”。
对于CaCl2溶液亚相,观察到更显着的效果。在这里,表面压力在低得多的密度下变得有限(∼140Å2/分子),而从LE相到LE+LC共存区的转变不太明显。在LC区域(π>20 mN/m),钙的存在导致脂质占据4Å2/m的额外空间,这正是钙离子的足迹。31这表明,在表面压力超过20 mN/m时,使头部基团水合的水被钙离子取代。在更高的表面压力(>25 mN/m)下,额外面积下降约2Å2/脂。分子面积差异的变化可以用两种方式来解释:(1)从1:1到2:1脂质/Ca2+复合物的转变,正如之前MD模拟所提出的那样;11(2)脂质头基构象的变化。6,23
对于DMP,水上压缩等温线(图2b)显示出与DPPC相同的相行为,具有LE、LE+LC和LC区域。然而,压缩后,每个分子可以达到更小的面积。这表明PS比PC更具可压缩性,这与相邻带电头基团之间的库仑排斥作用应扩大每个PS分子面积的直观表示相反。结果表明,相邻PS头基带电部分的强分子间配位在面积减小中起作用。16
对于1 M Ca2+溶液上的DMPS单分子膜,与观察到的纯水共存区的π)10 mN/M压力相比,LE+LC平台压力降低到π)5 mN/M;在较高的表面压力(π>20 mN/m)下,两条等温线的位移保持等于Ca2+足迹,4Å2/脂,未观察到明显转变为2:1脂/Ca2+复合物。
荧光显微镜。利用荧光显微镜可以观察到脂质单分子膜内的共存相。图3显示了三种典型表面压力下,用荧光探针标记的DPPC和DMPS单分子膜沿等温线获得的荧光图像。暗区对应于有序(LC)畴,亮区对应于无序(LE)畴。对于净水子相(图3中的左列),低表面压力下的LC域为DPPC(图3a)19的“豆”形和DMP的“花”形(图3d)。随着表面积的减少,LC域在凝聚成连续LC相(图3c)之前通过有序脂质的狭窄区域相互连接(图3b)33。从荧光图像分析中获得的有序暗区的归一化面积Adark(图4)表明,LC相在单层压缩后增加,并在π>10 mN/m时覆盖整个单层。
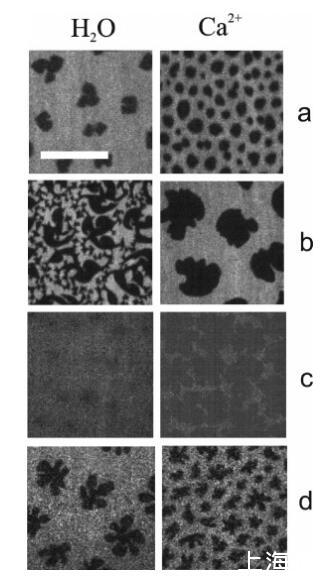
图3:水上DPPC(a、b、c)和DMPS(d)单层的荧光图像(左图)和1 M CaCl2溶液(右图),π)4 mN/M(a)、π)6.5 mN/M(b)、π)35 mN/M(c)和π)2 mN/M(d)。单分子膜用5 mol%罗丹明PE标记:亮区对应于LE相,暗区为LC结构域。比例尺代表15µm。所有图像的对比度都相同。
当钙存在于亚相时,PC和PS单分子膜在低表面压力下都可以观察到小的有序畴。更大面积的单层被这些∼与水相比,Ca2+的有序畴为3.5µm(见图4)。因此,低表面压力下的这些小区域是钙诱导的,它们占据∼表面的30%(对于PC)和20%(对于PS)。从下面的VSFG测量中也可以明显看出这些域的存在。到目前为止,这种钙离子诱导的结构域仅在混合单层系统中观察到。34,35在中等表面压力下(5 mN/m<π<25 mN/m),从图4可以明显看出,Ca2+的作用是降低有序畴的密度。
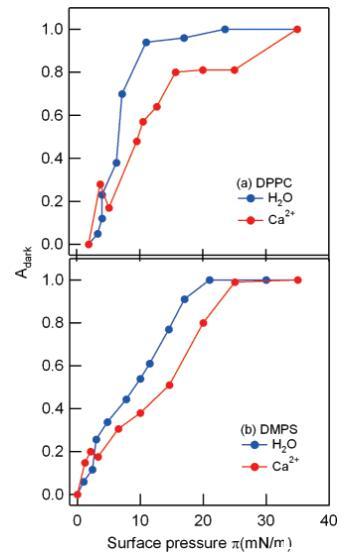
图4:。在净水(蓝色)和1 M CaCl2溶液(红色)上,DPPC(a)和DMPS(b)单分子膜的荧光图像中暗有序LC域的部分面积Adark随表面压力的变化。注意周围标记的局部最大值∼在存在Ca2+离子的情况下,两种脂质均为3 mN/m。
振动和频发生光谱学(VSFG)。VSFG是一种非线性振动光谱技术,可提供界面分子构象顺序和方向的表面特定信息,进一步研究了在Ca2+存在下这种改变相行为的分子起源。21,22为了量化离子对脂质尾部构象的影响,在C-H拉伸区域收集VSFG光谱。沿等温线测量了几个表面压力的光谱;图5显示了DPPC单层在20 mN/m和35 mN/m下三种不同亚相的光谱。可以观察到五种振动模式:以2876、2970和2938 cm-1为中心的峰值分别归属于CH3对称拉伸、CH3反对称拉伸和CH3费米共振。22 CH2对称和反对称拉伸频率约为2846和2920 cm-1。氘化DPPC脂质单层(d62和d75 DPPC)上的VSFG实验显示胆碱C-H伸展的信号非常低。
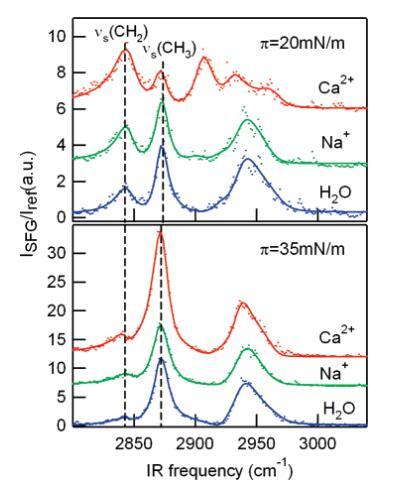
图5:。DPPC在π)20 mN/m(顶板)和π)35 mN/m(底板)时的VSFG光谱。垂直线表示亚甲基对称拉伸(νsCH2)和甲基对称拉伸(νsCH3)的位置。所有光谱均归一化为z切石英的参考信号。实线表示使用洛伦兹模型拟合数据。
单分子层压缩后,CH2强度显着降低。这可以从对称性参数中理解:当烷基链中的亚甲基从顺式构象变为反式构象时,会出现一个局部反转中心,从而使CH2模式SFG无效。23另一方面,CH3强度随着单层的压缩而急剧增加,这是由于链倾角的角度分布变窄所致。CH3和CH2对称拉伸振子强度可通过拟合数据获得。考虑到前面的论点,CH3和CH2对称拉伸振子强度的比值R为脂链的顺序提供了一个灵敏的经验度量。24为了可靠地提取R,使用洛伦兹多峰模型对数据进行全局分析(见支持信息中的公式2,实验部分),仅允许峰值振幅随表面压力的变化而变化。DPPC和DMPS的R在图6中绘制为表面压力的函数。
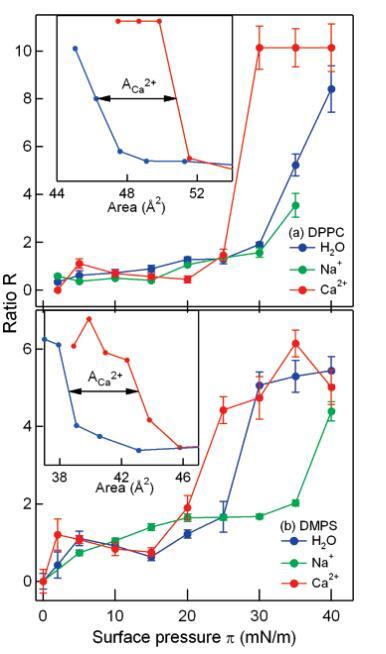
图6:。作为DPPC(a)和DMPS(b)单分子膜表面压力的函数,CH3和CH2对称拉伸振子强度的比值R:纯水(蓝色)、1 M NaCl溶液(绿色)和1 M CaCl2溶液(红色)。由于单分子膜的崩塌,在π)40 mN/m时,无法测定Na+-DPPC的比值R。由于压缩单层膜的νsCH2振幅的不确定性,在较高压力下,误差条较大。插图显示了作为每种脂质面积函数显示的比率R。请注意∼4Å2/脂质置换(解释为Ca2+足迹),与图2中的等温线一致。
对于纯水和NaCl亚相上的DPPC单分子膜,R随压力以类似的方式变化,在钠存在的情况下,R值稍小,但重复性较小。这表明,正如压区等温线也显示的那样,在Na+存在的情况下,DPPC单分子膜的有序性稍差,这与之前关于亚相中高浓度NaCl的报告一致,30但与分子动力学模拟不一致,11,13表明在∼10 mN/m表面压力。
对于含有Ca2+离子的亚相上的DPPC,R在5 mN/m处显示出一个小但可重复的峰值,随后在10到20 mN/m之间略有下降,然后在25 mN/m左右急剧增加。在低表面张力下,按顺序短暂增加(∼5 mN/m)与荧光显微镜的结果非常一致,这表明在这些压力下也会依次增加(图6)。在下文中,我们将尝试使用表面张力测量、荧光显微镜和VSFG测量的结果,提供单层相行为的统一图片。我们将首先讨论DPPC的具体结果,然后讨论DMP。
在VSFG测量中,当探测面积为∼10-2 mm2,但随着单层中平均阶数的增加,R值出现峰值。进一步压缩,诱导域合并成更大的域。同时,Adark增加,但Ca2+仍比水低20%(图4a,10 mN/m<π<25 mN/m)。这再次与VSFG光谱很好地一致,VSFG光谱表明这些表面压力下的脂质尾部更加无序,因为20 mN/m的CH2对称和反对称拉伸在亚相Ca2+中更加突出(图5)。
当表面压力达到25 mN/m时,R急剧增加,达到一个恒定的大值。有趣的是,R的急剧增加与等温线中脂质面积减少2Å2/脂质的位置一致(见图2),我们将其归因于(见上文)从1:1脂质/钙+复合物转变为2:1复合物。这意味着顺序的增加,即R的增加,涉及到由Ca2+-脂质相互作用的明显变化引起的头群的重新排列。当比较Ca2+溶液与纯水时,从R值增加的不同点也可以明显看出与Ca2+离子足迹相关的4Å2/脂质表面积。当绘制R与每种脂质的面积之比时,R的增加精确地移动了一个单位的ACa2+(插图6)。
当Ca2+-DPPC体系(π)25 mN/m的比值R急剧增大时,20%的单层面积仍被LE相覆盖。从VSFG获得的比率R的增加并不是由于脂尾中的笨拙缺陷消失,而是由于LC相中的烷基链朝向链与表面法线之间的较小角度θ重新定向。这可以从νsCH3和甲基反对称拉伸12的振幅之比得出结论(详细信息见支持信息),这表明DPPC在Ca2+溶液中的θ比在纯水中的θ小10°。在这些压力下,钙离子的存在导致脂质向表面法线协同倾斜。
对于DMP,尽管其头基结构和电荷不同,但Na+和Ca2+离子的结果与DPPC的结果非常相似。由于DMPS的非极性烃链长度略短(DMPS为14个碳,DPPC为16个碳),与DPPC相比,DMPS压缩单层的R值较低。先前已经报道了烷基链的长度与单层的相对顺序之间的直接相关性。36
对于Ca2+,DMPS单分子膜的比率R与DPPC单分子膜的趋势相似:在低表面压力下出现峰值(∼3 mN/m),并且在较高的表面压力(π)30 mN/m时会出现急剧增加,ACa2+开始向每个分子的更高面积方向移动(插图6)。同样,这与等温线数据和荧光图像非常一致。对于高表面压力(π>30mN/m)下的DMP,发现R与亚相中钙的存在无关,表明在高压下存在类似的酰基链排序。
可以注意到两种脂质之间的三个差异:首先,在5 mN/m<π<25 mN/m的区域,在荧光结果中,钙诱导的DPPC下降顺序对于DMPS是明显的,但在VSFG结果中则不太明显。其次,DPPC中观察到的从1:1到2:1脂质/钙复合物的转变对于DMPS来说并不明显,尽管ACa2+在荧光和VSFG数据中都出现。第三,虽然钠离子在高压(π>25 mN/m)下诱导两种脂质紊乱,但这种效应对DMP显着更大。目前,我们对这些观察结果没有一个令人满意的解释,除了差异必须源于集团结构的差异。
尽管DPPC和DMPS之间离子脂质相互作用的一些细节存在这些差异,但很明显,Ca2+在低表面压力下诱导两种脂质中有序结构域的形成,在中等表面压力下诱导无序结构域的形成(对于DPPC),在最高表面压力下诱导高度有序结构域的形成。对于这两种脂质,观察到明显的证据表明脂质和Ca2+之间形成复合物,但Na+不存在。钠对脂质单分子膜的影响要小得多,主要是在高表面压力下引起紊乱(最明显的是DMP)。在研究头部附近水分子的方向时,观察到两种脂质之间的其他相似性。O-D拉伸振动中D2O亚相上DPPC和DMPS的VSFG光谱(未显示数据)表明,水合水分子在阴离子和两性离子头基附近以相同的方式取向。这表明PC表现为阴离子脂质,因为DPPC的头基与其胆碱基团朝向界面。32因此,钙与PC和PS磷脂的相互作用类似并不奇怪,很可能与磷酸盐部分协调。
结论
综上所述,我们结合三种互补技术来研究阳离子对PC和PS单分子膜的影响。我们的结果表明,钠离子对DPPC单分子膜的影响很小,主要是扩张脂质单分子膜。另一方面,钙有明显的效果,这在很大程度上取决于表面压力。在低表面压力下,钙离子诱导形成小而有序的脂质结构域,随着表面压力的增加,这些脂质结构域合并成更大的脂质结构域。在高表面压力下,Ca2+对两性离子脂质和阴离子脂质单层都产生“缩合效应”,表明离子优先与脂质头基中的磷酸部分相互作用。在VSFG和表面张力测量中,Ca2+与脂质结合的分子特征从水和Ca溶液上的单分子膜之间的信号变化中可以明显看出,对应于4Å2/脂的面积变化,精确地说是Ca2+离子的表面积。
确认
这项工作是“材料粘贴voor Fundamenteel Onderzoek(FOM)”研究项目的一部分,该项目由“荷兰voor Wetenschapelijk Onderzoek(NWO)”组织资助。我们感谢本特·卡塞莫(BengtKasemo)建议进行这项实验,并感谢克里斯蒂安·蒂舍尔(Christischer)和拉杰什·皮莱(RajeshPillai)对荧光显微镜的帮助。
可用支持信息:实验部分,DMPS单分子膜的VSFG光谱,以及使用和频生成的分子取向分析。此材料可通过以下网址免费获取:http://pubs.acs.org.










